GM quicker 2
コメ・ナタネ・ジャガイモからのDNA抽出キット| 品名 | Code No. | 包装単位 | 価格 | 備考 |
|---|---|---|---|---|
| GM quicker 2 | 310-06591 | 50回用 | 50,000円 | |
製造元 (株)ニッポンジーン
表示価格は希望納入価格 (税別) です。
製品説明
GM quicker 2 50回用
GM quicker 2 は、穀物であるコメ、ナタネ、ジャガイモからDNAを抽出するためのキットです。本キットでは、抽出対象を穀物へ特化させることによって、約40 分間という短い時間で高い精製度のDNAを抽出することができます。また、本キットはα- アミラーゼを使用することにより、うるち米のみならずもち米にも対応した設計となっており、コメ未知試料の検査において対応が可能です。さらに、コメおよびナタネに関しては、1 粒検査のためのDNA 抽出にも対応が可能です。
特長
・コメ、ナタネ、ジャガイモから約40分で高精製度のDNAを抽出可能・抽出操作にフェノールやクロロホルムなどの毒性有機溶媒が不要・試料のクロスコンタミネーション防止に配慮したキット設計・抽出したDNAはPCRや制限酵素反応にそのまま使用可能
- GM quicker 2 は、厚生労働省 「平成18年9月15日付け食安輸発第0915002号」において、遺伝子組換え米(LLRICE601)の検査法(DNA抽出精製)に収載されました。
- GM quicker 2 は、厚生労働省 「平成19年1月26日付け食安監発第0126005-8号」における「安全性未審査の中国米加工品の検知法」に収載されました。
- GM quicker 2 は、厚生労働省 「平成21年6月26日付け食安監発0626008号」において、安全性未審査の遺伝子組換えナタネ(RT73 B.rapa)の暫定検査法(スクリーニング検査のDNA抽出精製 法)に収載されました。
▲このページのトップへ
製品内容
使用回数
DNA 抽出を50 回行うことができます。
試料の種類やサイズによって必要な試薬量が変わります。不足分については単品でご購入下さい。
| 構成品 | 容量 | 保存 | 備考 |
|---|---|---|---|
| GE1 Buffer | 40 ml x 1 本 | 室温 | |
| GE2-K Buffer | 5 ml x 1 本 | 室温 | |
| GB3 Buffer | 12.5 ml x 1 本 | 室温 | |
| GW Buffer | 40 ml x 1 本 | 室温 | エタノール含有 |
| TE (pH8.0) | 10 ml x 1 本 | 室温 | |
| Proteinase K (20 mg/ml) | 1 ml x 1 本 | -20°C | |
| α-Amylase (高濃度品) | 0.1 ml x 1 本 | -20°C | |
| RNase A (100 mg/ml) | 0.5 ml x 1 本 | 室温 | RNase A を長期間ご使用にならない場合には、冷蔵保存もしくは冷凍保存(-20°C)して下さい。 |
| Spin Column | 50 本 x 1 袋 | 室温 | 上部パーツ:カラム、下部パーツ:Collection Tube |
輸送方法
ニッポンジーンから直送する場合、室温品を入れたキット箱と-20°C品とドライアイスを入れたスチロールボックスを一つの段ボール箱にまとめて入れて常温で輸送しています。
▲このページのトップへ
使用例
実験例:1 コメからのDNA抽出プロトコール
1. コメをフードミル等で粉砕し、コメ粉末試料を調製する。
2. 2.0 ml チューブに 0.5 gのコメ粉末試料を秤量し、700 µl のGE1 Buffer、20 µlのProteinase K、2 µlのα-Amylase および10µl の RNase A をそれぞれ添加し、ボルテックスミキサーにて 30 秒間攪拌する。
3. 15分間、60°Cで加温する。
4. 85 µl の GE2-K Buffer を添加し、ボルテックスミキサーにてよく混和する。
5. 遠心(≧13K x g, 5分間, 室温)する。
6. 上清 400 µlを新しい 1.5ml チューブに移す。
7. 150 µl の GB3 Buffer を添加後、150 µl のイソプロパノールを添加し、10~12 回チューブを激しく転倒させ、よく混和する。
8. 7の混合液を Spin Column に全量移し、遠心(13K x g, 30秒間, 室温)し、濾液は廃棄する。
9. 650 µl の GW Buffer を Spin Column に添加した後、遠心(13K x g, 60秒間, 室温)し、濾液は廃棄する。
10. Spin Columnを新しい 1.5 ml チューブに移す。
11. 50 µlの TE(pH8.0)を滴下した後、3 分間室温で静置する
12. 遠心(13K x g, 60秒間, 室温)し、濾液を回収する。
実験例:2 コメ1粒からの DNA抽出プロトコール
1. コメ種子1粒をアルミホイル等で包み、金槌等で粉砕し、コメ粉末試料を調製する。
2. 1.5 ml チューブにコメ粉末試料を添加し、250µl のGE1 Buffer、10 µlのProteinase K、2 µlのα-Amylase および5 µl の RNase A をそれぞれ添加し、ボルテックスミキサーにて 30 秒間攪拌する。
3. 15分間、60°Cで加温する。
4. 40 µl の GE2-K Buffer を添加し、ボルテックスミキサーにてよく混和する。
5. 遠心(≧13K x g, 5分間, 室温)する。
6. 上清 200 µlを新しい 1.5ml チューブに移す。
7. 75 µl の GB3 Buffer を添加後、75 µl のイソプロパノールを添加し、10~12 回チューブを激しく転倒させ、よく混和する。
8. 7の混合液を Spin Column に全量移し、遠心(13K x g, 30秒間, 室温)し、濾液は廃棄する。
9. 650 µl の GW Buffer を Spin Column に添加した後、遠心(13K x g, 60秒間, 室温)し、濾液は廃棄する。
10. Spin Columnを新しい 1.5 ml チューブに移す。
11. 50 µlの TE(pH8.0)を滴下した後、3 分間室温で静置する
12. 遠心(13K x g, 60秒間, 室温)し、濾液を回収する。
→実験データはこちら
実験例:3 ナタネからのDNA抽出プロトコール
1. ナタネ種子をフードミル等で粉砕し、ナタネ粉末試料を調製する。
2. 2.0 ml チューブで 0.2gのナタネ粉末試料を秤量し、800 µl のGE1 Buffer、20µlのProteinase K、10µl の RNase A をそれぞれ添加し、ボルテックスミキサーにて 30秒間攪拌する。
3. 15分間、65°Cで加温する。
4. 100 µl の GE2-K Buffer を添加し、ボルテックスミキサーにてよく混和する。
5. 遠心(≧13K x g, 5分間, 室温)する。
6. 上清 350 µlを新しい 1.5ml チューブに移す。
7. 130 µl のGB3 Buffer を添加後、130 µlのイソプロパノールを添加し、10~12 回チューブを激しく転倒させ、よく混和する。
8. 7の混合液を Spin Column に全量移し、遠心(13K x g, 30秒間, 室温)し、濾液は廃棄する。
9. 650 µl の GW Buffer を Spin Column に添加した後、遠心(13K x g, 60秒間, 室温)し、濾液は廃棄する。
10. Spin Columnを新しい 1.5 ml チューブに移す。
11. 50 µlの TE(pH8.0)を滴下した後、3 分間室温で静置する
12. 遠心(13K x g, 60秒間, 室温)し、濾液を回収する。
実験例:4 ナタネ1粒からのDNA抽出プロトコール
1. 1.5 ml チューブにナタネ種子1粒を入れ、ペッスルでよく破砕する。
2. 250 µl のGE1 Buffer、10 µlのProteinase K、5 µl の RNase A をそれぞれ添加し、ボルテックスミキサーにて 30 秒間攪拌する。
3. 15分間、65°Cで加温する。
4. 40 µl の GE2-K Buffer を添加し、ボルテックスミキサーにてよく混和する。
5. 遠心(≧13K x g, 5分間, 室温)する。
6. 上清 200 µl を新しい 1.5ml チューブに移す。
7. 75 µl の GB3 Buffer を添加後、75 µl のイソプロパノールを添加し、10~12 回チューブを激しく転倒させ、よく混和する。
8. 7の混合液を Spin Column に全量移し、遠心(13K x g, 30秒間, 室温)し、濾液は廃棄する。
9. 650 µl の GW Buffer を Spin Column に添加した後、遠心(13K x g, 60秒間, 室温)し、濾液は廃棄する。
10. Spin Columnを新しい 1.5 ml チューブに移す。
11. 50 µlの TE(pH8.0)を滴下した後、3 分間室温で静置する
12. 遠心(13K x g, 60秒間, 室温)し、濾液を回収する。
実験例:5 生ジャガイモからのDNA抽出プロトコール
1. 生ジャガイモを約3 mm角のサイコロ状にナイフで細かく切断する。
2. 1.5 ml チューブで 0.3 gの生ジャガイモ粉末試料を秤量し、500µl のGE1 Buffer、4 µl の RNase A をそれぞれ添加してペッスルでよく破砕後、ボルテックスミキサーにて 30 秒間攪拌する。
3. 85 µl の GE2-K Buffer を添加し、ボルテックスミキサーにてよく混和する。
4. 遠心(≧13K x g, 5分間, 室温)する。
5. 上清 400 µl を新しい 1.5ml チューブに移す。
6. 150 µl の GB3 Buffer を添加後、150 µl のイソプロパノールを添加し、10~12 回チューブを激しく転倒させ、よく混和する。
7. 6の混合液を Spin Column に全量移し、遠心(13K x g, 30秒間, 室温)し、濾液は廃棄する。
8. 650 µl の GW Buffer を Spin Column に添加した後、遠心(13K x g, 60秒間, 室温)し、濾液は廃棄する。
9. Spin Columnを新しい 1.5 ml チューブに移す。
10. 50 µlの TE(pH8.0)を滴下した後、3 分間室温で静置する
11. 遠心(13K x g, 60秒間, 室温)し、濾液を回収する。
Data 1: コメ種子1粒からのDNA 抽出
本キットを用いてコメ種子1粒からDNA 抽出を行った。いずれの種子からもDNA を抽出することができた。
本キットで抽出したDNA 50 µl のうちの20 µl 量を 1% Agarose S で電気泳動した。

Data 2: コメ種子1粒から抽出したDNAのPCR
本キットを用いて抽出した、コメ(コシヒカリ)種子1粒からの DNAサンプル0.1µl を鋳型とし、コシヒカリ特異的な領域をPCRにて増幅した。 PCR産物の一部 (10 µl) を 2% Agarose S ゲルで電気泳動した。

Data 3: コメ種子からのDNA抽出と制限酵素消化
本キットで各種コメ種子から抽出したDNA を制限酵素EcoRⅠで消化した。

Data 4: 乾燥コンブからのDNA抽出
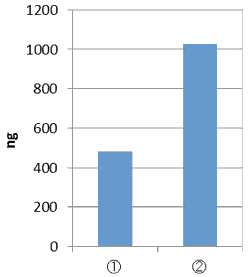
① GM quicker 2
② GM quicker 2 + HULKアルギン酸分解酵素
乾燥コンブから、本品 (コメDNA抽出プロトコール) を用いてDNAを抽出した。HULKアルギン酸分解酵素を加える場合と加えない場合とで、DNA収量を比較した。
結果 本製品とHULKアルギン酸分解酵素を組み合わせることで、DNA収量が増加した。
→詳しい実験プロトコールやその他の実験例はこちら (Data 3)
▲このページのトップへ
資料 Data Sheet
製品マニュアル
SDS(Safety Data Sheet)
▲このページのトップへ
関連情報
備考
- 本品は試験研究用試薬です。医薬品の用途、その他の目的には使用しないでください。
- GM quicker 2は「(別添)安全性未審査の組換えDNA技術応用食品の検査方法」のコメ(63Bt、NNBt、CpTI)の検査方法、コメ(LL601)の検査方法、ナタネ(RT73 B. rapa)の検査方法に準拠した試薬です。(食安発1116第3号)
関連製品
- GM quicker シリーズ関連製品(バッファー単品販売)
- バッファー TE(pH 8.0)
- Collection Tube(コレクションチューブの単品パッケージ)
- HULK アルギン酸分解酵素(褐藻類からの核酸抽出)
問い合わせ先
