HULK アルギン酸分解酵素
HULK Alginate lyase| 品名 | Code No. | 包装単位 | 価格 | 備考 |
|---|---|---|---|---|
| HULK アルギン酸分解酵素 | 319-08261 | 5 mg | 35,600円 | |
製造元 (株)ニッポンジーン
表示価格は希望納入価格 (税別) です。
製品説明
本品は、Flavobacterium属細菌由来のアルギン酸リアーゼで、大腸菌で発現・精製した組換え酵素です。アルギン酸を効率よく分解することができます。
アルギン酸はコンブ等の褐藻類に多く含まれる粘性の高い多糖類です。褐藻類から核酸を抽出する際に、本酵素で処理することによって粘性がなくなり、効率的に核酸抽出を行うことができるようになります。
製品名の HULK は、Hokkaido University alginate Lyase for Kelp degradation の略です。
HULKアルギン酸分解酵素の特徴
- 至適温度:50°C
- 至適pH:7.8~8.0
- 至適NaCl濃度:100 mM
- 40°Cで30分加熱後も95%以上の活性を保持する。
- 基質に対する比活性は、アルギン酸=PolyM>PolyMG>PolyG
| 起源 | 遺伝子組換え大腸菌 |
|---|---|
| 酵素形状 | 20 mmol/l Tris-HCl (pH 8.0), 100 mmol/l NaCl, 50% Glycerol |
| 活性 | ≧5,000 units/mg |
| 単位の定義 | 1 unitは、0.1% アルギン酸ナトリウムを基質として、30°Cにおいて235 nmの値が1分間に0.1上昇する酵素活性とする。 |
▲このページのトップへ
製品内容
保存方法
-20°C
| 構成品 | 容量 | 備考 |
|---|---|---|
| HULK アルギン酸分解酵素 (5 mg/ml) | 1 ml x 1 |
▲このページのトップへ
使用例
Data 1 HULK アルギン酸分解酵素によるアルギン酸分解経時変化
反応条件: 10 mM NaPi (pH 8.0), 0.1 M NaCl, 0.1 mg/ml BSA, 0.5% alginate, and 1 µg/ml HULKアルギン酸分解酵素 at 30°C.
 | 硫酸による発色(全糖を検出) 反応前(0分)は、原点にのみアルギン酸のスポットが確認できる。 30分後には、ほぼ全てオリゴ糖化し、2時間以上反応させると2~5糖が主要な分解物となる。 |
|---|---|
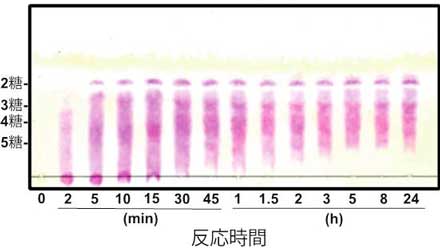 |
チオバルビツール酸(TBA)による発色(不飽和糖を検出) 反応前(0分)は、いずれのスポットも確認できない(基質のアルギン酸は飽和糖のため)。 反応開始後、直ちに不飽和糖(ピンク色のスポット)が生じる。 なお、本検出法により単糖由来のDEHが検出されないことから、最小分解物は2糖であることが分かる。 |
本実験データは、国立大学法人 北海道大学・大学院水産科学研究院 井上 晶博士よりご提供いただきました。
Data 2 他社製品との比較
本酵素の活性測定方法を用いて活性を算出し、HULKアルギン酸分解酵素と他社アルギン酸リアーゼの比活性を比較した。
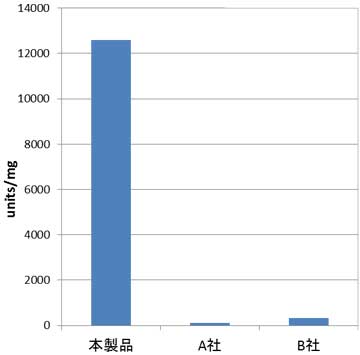
HULKアルギン酸分解酵素は他社アルギン酸リアーゼと比較して、30~80倍比活性が高かった。
Data 3 コンブからのDNA抽出
生マコンブと三種類の乾燥コンブから、DNA抽出キットGM quicker 2 (改変コメDNA抽出プロトコール) を用いてDNAを抽出した。HULKアルギン酸分解酵素を加える場合と加えない場合とで、DNA収量を比較した。また、抽出したDNAを鋳型としてPCRを行った。
プロトコール
生コンブ 50 mg、または乾燥コンブ粉砕試料5-20 mgを2.0 ml容量マイクロチューブに入れる
↓←700 µl のGE1 Bufferを添加
↓←20 µl のProteinase Kを添加
↓ 生コンブはペッスルですりつぶす、乾燥コンブはボルテックスミキサーにて混和
↓ 15分間、60°Cで加温
↓←85 µl の GE2-K Buffer を添加し、ボルテックスミキサーにて混和
↓ 遠心(≧13,000 x g, 5分間, 室温)
上清 400 µlを新しい 1.5ml チューブに移す
↓←10 µl のRNase Aを添加
↓←20 µl のHULKアルギン酸分解酵素を添加
↓ 15分間、37°Cで加温
↓←150 µl の GB3 Buffer を添加
↓←150 µl のイソプロパノールを添加し、10~12 回転倒混和
混合液を Spin Column に全量移す
↓ 遠心(13,000 x g, 1分間, 室温)し、濾液は廃棄
↓←650 µl の GW Buffer を Spin Column に添加
↓ 遠心(13,000 x g, 1分間, 室温)し、濾液は廃棄
Spin Columnを新しい 1.5 ml チューブに移す
↓←50 µlの 10mM Tris-HCl(pH8.5)またはTE(pH8.0)を滴下
↓ 3 分間室温で静置
↓ 遠心(13,000 x g, 1分間, 室温)
回収した濾液(Genomic DNA)
生マコンブからのDNA抽出
約50 mgの生マコンブ※から、上記プロトコールを用いてDNAを抽出した(n=4)。抽出したDNAの1/5量をアガロースゲル電気泳動に用いた。
また、抽出したDNAを鋳型としてPCRを行った。
※ 本実験に使用したマコンブは、国立大学法人 北海道大学・大学院水産科学研究院 井上 晶 博士よりご提供いただきました。
アガロースゲル電気泳動
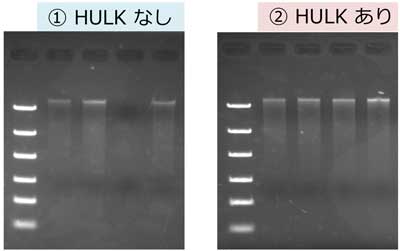 |
① GM quicker 2 (HULKなし-) ② GM quicker 2 + HULKアルギン酸分解酵素 (HULKあり+) 0.8% Agarose S マーカー: Gene Ladder Fast 2 |
|---|
PCR
抽出したコンブDNAを鋳型に様々な増幅鎖長のPCRを行い、反応液の一部(10 µl)を Agarose Sゲルで電気泳動した。
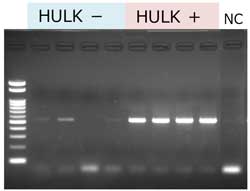 |
増幅鎖長 510 bp 2% Agarose S マーカー: Gene Ladder 100 NC: ネガティブコントロール(鋳型DNAなし) |
|---|---|
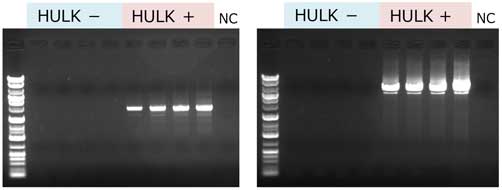 |
(左)増幅鎖長 2680 bp (右)増幅鎖長 6661 bp 0.8% Agarose S マーカー: Gene Ladder Wide 1 NC: ネガティブコントロール(鋳型DNAなし) |
結果
本製品とGM quicker 2を組み合わせて抽出したDNAは、PCR阻害が認められなかった。
乾燥コンブからのDNA抽出
市販の3種類の乾燥コンブから上記プロトコールを用いてDNAを抽出した(n=2)。 HULKアルギン酸分解酵素を加える場合と加えない場合で、サンプル1 mgあたりの収量を比較した。 また、抽出したDNA 10 ng を鋳型にPCRを行い(490 bp増幅)、反応液の一部(10 µl)を2% Agarose Sゲルで電気泳動した。
1 mgあたりのDNA収量とPCR
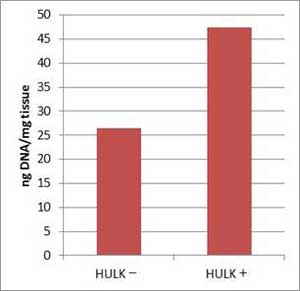 |
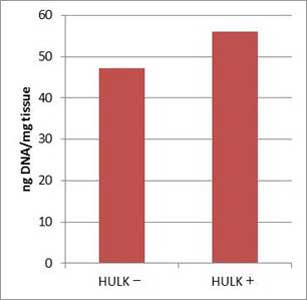
(左) 羅臼昆布 約20 mgから抽出した場合の 1 mgあたりの収量 (下) PCR 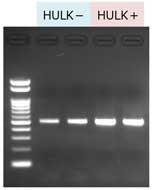 |
|---|---|
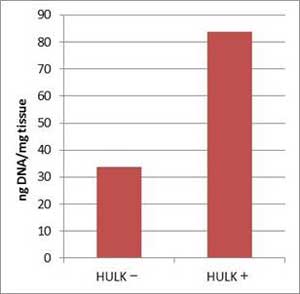 |
(左) 根昆布 約20 mg(北海道産)から抽出した場合の 1 mgあたりの収量 (下) PCR 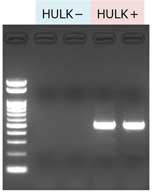 |
 |
(左) とろろ昆布 約5 mg(北海道産)から抽出した場合の 1 mgあたりの収量 (下) PCR 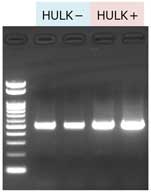 |
結果
本製品とGM quicker 2を組み合わせて抽出したDNAは、PCR阻害が認められなかった。
▲このページのトップへ
資料 Data Sheet
製品マニュアル
SDS(Safety Data Sheet)
リーフレット
▲このページのトップへ
関連情報
備考
- 本品は試験研究用試薬です。医薬品の用途には使用しないでください。
純度
- 本酵素10 µgと基質DNAを37°Cで1時間反応させてもDNAのアガロースゲル電気泳動パターンに変化は認められない。
- 本酵素10 µgと基質RNAを37°Cで1時間反応させてもRNAのアガロースゲル電気泳動パターンに変化は認められない。
参考文献
- Inoue, A., Takadono, K., Nishiyama, R., Tajima, K., Kobayashi, T., and Ojima, T. (2014). Characterization of an alginate lyase, FlAlyA, from Flavobacterium sp. strain UMI-01 and its expression in Escherichia coli. Marine Drugs, 12, 4693-4712.
- Inoue, A., Nishiyama, R., and Ojima, T. (2016). The alginate lyases FlAlyA, FlAlyB, FlAlyC, and FlAlex from Flavobacterium sp. UMI-01 have distinct roles in the complete degradation of alginate. Algal Research, 19, 355-362.
- Inoue, A. (2018). Characterization of PL-7 family alginate lyases from marine organisms and their applications. Methods in Enzymology, 605, 499-524.
関連製品
問い合わせ先
- 購入に関するお問い合わせ先
- 富士フイルム和光純薬株式会社および同社代理店・特約店
- 富士フイルム和光純薬株式会社 製品検索サイト
- 製品に関するお問い合わせ先
- 株式会社ニッポンジーン 学術営業課
